Ernesto Araújo fez força para governo comprar vacina superfaturada
 Foto: Prakash Singh/AFP – 1/5/21
Foto: Prakash Singh/AFP – 1/5/21
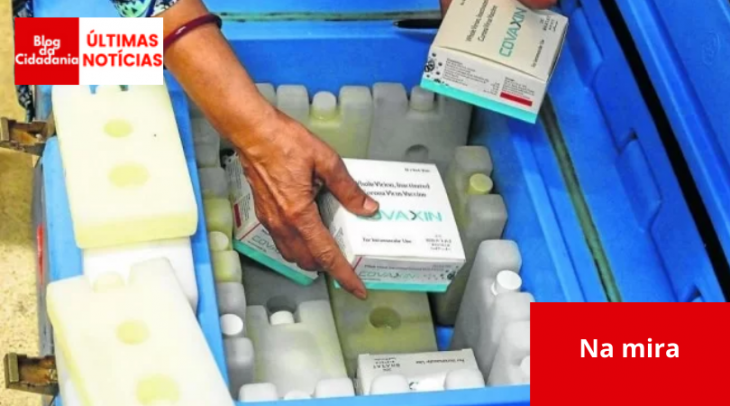
Um telegrama do Itamaraty enviado pela Secretaria de Estado das Relações Exteriores (SERE) à embaixada brasileira de Nova Délhi, em março deste ano, mostra o empenho da pasta comandada à época por Ernesto Araújo em acelerar a aprovação da vacina contra covid-19 Covaxin pela Agência Nacional de Vigilância Sanitária (Anvisa). O imunizante é produzido pelo laboratório indiano Bharat Biotech, representado no Brasil pela Precisa Medicamentos, que assinou o contrato com o Ministério da Saúde no dia 25 de fevereiro deste ano, de R$ 1,6 bilhão, para aquisição de 20 milhões de doses de imunizantes.
O telegrama, enviado em caráter sigiloso à Comissão Parlamentar de Inquérito (CPI) e ao qual o Correio teve acesso, é datado de 26 de março e “roga” providência para que seja feita uma comunicação com as autoridades indianas a fim de agilizar documentos para a aprovação da importação da Covaxin.
“Informo e rogo providências”, começa o pedido de prioridade “urgentíssimo”, enviado cinco dias antes de a Anvisa barrar a importação do imunizante. Em 30 de março, a agência negou a certificação de boas práticas de fabricação à Bharat Biotech International, justificando que a empresa não adota todas as precauções necessárias para garantir a esterilidade do produto e não possui uma estratégia de controle adequada para certificar a pureza da vacina. No dia seguinte, foi a vez de os técnicos barrarem a importação da vacina.
A solicitação de importação da Covaxin foi enviada em 22 de março pelo Ministério da Saúde, como consta no próprio telegrama, e foi barrada em 31 de março pela Anvisa. Na justificativa para rejeitar o pedido, o diretor da 5ª diretoria da Anvisa e relator do processo, Alex Machado Campos, apontou inconsistência na documentação, com lacunas importantes para garantir que a eficácia, segurança e qualidade da vacina, tal como descrita no estudo clínico, possam ser cumpridas. Segundo Campos, “a área técnica identifica riscos e incertezas no uso da vacina Covaxin nas condições atuais”, de maneira que não foi possível determinar “a relação benefício risco da com as informações disponíveis até o momento”.
A Anvisa já havia antecipado não ter condições de deliberar sobre a aprovação por falta de documentos. A agência solicitou a documentação após ter recebido o pedido de análise por parte do Ministério da Saúde, entre os dias 22 e 23 de março. Na época, a agência afirmou que “mesmo após resposta do ministério, ainda restam pendentes, além de esclarecimentos pontuais, a apresentação de documentos necessários à análise”, como um relatório técnico da avaliação da vacina emitido ou publicado pela autoridade sanitária indiana, certificados de liberação dos lotes a serem importados e licenciamento de importação
Em razão desses obstáculos, o Itamaraty tentou intervir antes da decisão da agência, no intuito de dar novos rumos às análises. O Ministério das Relações Exteriores informou à embaixada de Nova Déli sobre a solicitação de autorização para importação de 20 milhões de doses que foram adquiridas pelo Ministério da Saúde. O imunizante já tinha autorização de uso emergencial na Índia, o que permitiria a importação ao Brasil, mesmo sem estudo fase 3 concluído (ou mesmo iniciado, no caso da Covaxin). A importação de vacina contra covid-19 nesses parâmetros só foi possível a partir da Lei 14.124, aprovada no dia 10 de março no Congresso. Antes, a lei era uma Medida Provisória (MP) de janeiro deste ano.
A lei visa facilitar a compra de vacinas, permitindo dispensa de licitação e que a Anvisa possa dar autorização excepcional e temporária para importação e uso de vacinas mesmo sem estudo fase 3 concluído, desde que haja registro prévio por autoridades sanitárias estrangeiras dos Estados Unidos, União Europeia, do Japão, da China, do Reino Unido, do Canadá, da Coreia do Sul, da Rússia, da Argentina, da Austrália e Índia. A inclusão da Índia na MP foi feita por emenda pelo líder do governo, deputado federal Ricardo Barros (PP-PR), o que possibilitou a importação do imunizante.
O telegrama pontua que, segundo a Anvisa, a referida lei e uma resolução da diretoria colegiada (RDC) determinavam que o relatório da agência regulatória indiana, emitindo a autorização para uso emergencial do imunizante na Índia, “deve ser capaz de comprovar que o produto atende aos padrões de qualidade, de eficiência e de segurança estabelecidos pela Organização Mundial da Saúde (OMS), pelo Conselho Internacional para Harmonização de Requisitos Técnicos para Medicamentos de Uso Humano (ICH) ou pelo Esquema de Cooperação de Inspeção Farmacêutica, principais foros internacionais de convergência regulatória” e dos quais a Anvisa é integrante.
O relatório da agência indiana, por sua vez, referia-se apenas ao comprovante de autorização de uso emergencial pela autoridade indiana. “Não contempla aspectos técnicos de qualidade, segurança e eficácia referentes à avaliação da vacina por aquela autoridade”, avisa o Itamaraty. O órgão afirma, ainda, que a Anvisa informou ter “reiteradamente buscado agendar reunião técnica” com a agência regulatória da Índia, mas não obteve sucesso até então.
“Nessas condições, muito agradeceria a gentileza de transmitir o que precede, bem como realizar as gestões cabíveis, junto às autoridades indianas correspondentes, com vistas a garantir seu apoio no sentido de permitir que a Anvisa tenha acesso as necessárias informações em seu processo de avaliação do referido pedido”, ressalta o Itamaraty no telegrama.
